|
 |
 |
 |
Cancer de la prostate - Jevtana® réduit le risque de décès de 30% - France |
 |
 |
 |
Lundi 21 juin 2010
Cancer de la prostate : Jevtana® réduit le risque de décès de 30%
Une nouvelle très importante pour l’ensemble des personnes concernées par le cancer de la prostate : Sanofi-Aventis annonce au 17 juin, l’AMM délivrée par la Food and Drug Administration (FDA) des Etats-Unis à Jevtana® (cabazitaxel) en injection, en association avec de la prednisone, pour le traitement en seconde intention des patients atteints d’un cancer de la prostate métastatique. En réduisant le risque de décès de 30%, ce médicament est le premier traitement à apporter une amélioration significative de la survie.
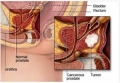
3ème forme de cancer dans le monde en termes d’incidence et sixième en termes de mortalité, le cancer de la prostate est la deuxième cause de décès par cancer chez les hommes.
Jevtana, un inhibiteur des microtubules, en association avec de la prednisone a été approuvé sur la base des résultats d’une étude de phase III TROPIC portant sur 755 patients atteints d’un cancer de la prostate métastatique hormono-résistant traités antérieurement par une chimiothérapie à base de docétaxel.
Les résultats de cette étude ont montré une réduction statistiquement significative de 30 % [HR=0,70 (IC à 95 % : 0,59-0,83) ; p<0,0001] du risque de décès chez les patients recevant Jevtana en association avec de la prednisone par rapport à une chimiothérapie prévoyant l’administration d’une dose standard de mitoxantrone et de prednisone.
« Il s’agit d’une nouvelle très importante pour l’ensemble des personnes concernées par le cancer de la prostate, car ce médicament comble un besoin thérapeutique important. Grâce à l’approbation de Jevtana, les professionnels de santé ont désormais accès à un nouveau traitement pour les patients atteints de la forme la plus avancée du cancer de la prostate, pour laquelle il existe peu d’options thérapeutiques », a déclaré le Dr Oliver Sartor, investigateur principal de l’étude TROPIC pour l’Amérique du Nord.
Des réactions plus fréquentes motivant l’arrêt du traitement:
Dans l’étude TROPIC, les réactions indésirables les plus fréquentes ayant motivé l’arrêt du traitement dans le groupe Jevtana incluaient la neutropénie et l’insuffisance rénale. Les réactions indésirables ayant motivé l’arrêt du traitement ont concerné 18 % des patients ayant reçu Jevtana et 8 % des patients ayant reçu de la mitoxantrone. 18 cas de décès (5%) dus à d’autres causes qu’à la progression de la maladie ont été rapportés chez les patients recevant Jevtana, dans les 30 jours suivant l’administration de la dernière dose de l’étude, contre 3 cas de décès (moins de 1%) rapportés chez les patients traîtés par mitoxantrone.
Fast track: Jevtana a bénéficié en novembre 2009 d’une revue accélérée (« fast track ») de la FDA. Le dossier d’AMM, qui a été soumis en continu, a été finalisé en mars 2010 et s’est vu accorder le statut de revue prioritaire (« priority review ») en avril 2010. Moins de 3 mois après, Jevtana® était approuvé. Jevtana devrait être commercialisé aux Etats- Unis dès cet été et est d’ores et déjà étudié par l’Agence européenne des médicaments (EMA).
santelog Yann-Mickaël Dadot - http://www.santelog.com
 |
|
|
|
|
23/05/2011 + Vidéocapsules pour explorer le côlon - France
 Des vidéocapsules pour explorer le côlon. Les vidéocapsules, utilisées depuis une dizaine d'années pour examiner l'intestin grêle, sont en train... Des vidéocapsules pour explorer le côlon. Les vidéocapsules, utilisées depuis une dizaine d'années pour examiner l'intestin grêle, sont en train... |
19/05/2011 + Cancer du colôn : L’aspirine n’a pas fini de nous surprendre !
 Les chercheurs lui découvrent de nouvelles vertus à l'aspirine. Les chercheurs lui découvrent de nouvelles vertus à l'aspirine. |
18/05/2011 + Cancer du côlon : une heure d’exercice par semaine pour réduire le risque
 L'exercice physique pourrait contribuer à réduire les risques de cancer du côlon. L'exercice physique pourrait contribuer à réduire les risques de cancer du côlon. |
17/05/2011 + La vie de bureau doublerait le risque de cancer du côlon
 Selon une étude australienne, la vie de bureau doublerait le risque de cancer du côlon Selon une étude australienne, la vie de bureau doublerait le risque de cancer du côlon |
16/05/2011 + Maladie de Crohn - Une marche pour joindre l'utile à l'agréable - Saint-Hilaire-de-Lusignan - France
 Une rendonnée dont les bénéfices seront versés à l'association François Aupetit Une rendonnée dont les bénéfices seront versés à l'association François Aupetit |
18/05/2007
- La chasse aux faux médicaments
 7 % des médicaments vendus aujourd'hui dans le monde seraient des faux, selon des chiffres avancés lors des rencontres parlementaires européennes sur... 7 % des médicaments vendus aujourd'hui dans le monde seraient des faux, selon des chiffres avancés lors des rencontres parlementaires européennes sur... |
15/01/2008
- Les hôpitaux flamands sont surchargés
 Les hôpitaux en Flandre sont surchargés, notamment en raison de la forte augmentation du nombre d'infections des voies respiratoires. Les hôpitaux en Flandre sont surchargés, notamment en raison de la forte augmentation du nombre d'infections des voies respiratoires. |
17/05/2007
- Les soins de santé ne seront pas défédéralisés.
 Pour Rudy Demotte, aucune raison objective n'existe en faveur d'une défédéralisation des soins de santé. Pour Rudy Demotte, aucune raison objective n'existe en faveur d'une défédéralisation des soins de santé. |
16/05/2007
- Appareillages pour stomies
 À moins que votre stomie ne soit temporaire, vous aurez à vous servir d’un appareillage recueillant les émissions de la stomie le reste de votre vie. À moins que votre stomie ne soit temporaire, vous aurez à vous servir d’un appareillage recueillant les émissions de la stomie le reste de votre vie. |
15/05/2007
- Un nouveau médicament contre le cancer du rein
 Le groupe pharmaceutique Bayer a annoncé la commercialisation d’un médicament innovant, le Nexavar ®, dans le traitement du cancer du rein avancé. Le groupe pharmaceutique Bayer a annoncé la commercialisation d’un médicament innovant, le Nexavar ®, dans le traitement du cancer du rein avancé. |
14/05/2007
- Stomie : Comment faire en milieux scolaire
 Lorsqu’un enfant stomisé est scolarisé, il vaut mieux prendre quelques précautions ... Lorsqu’un enfant stomisé est scolarisé, il vaut mieux prendre quelques précautions ... |
13/05/2007
- Fibroscopie
 Une fibroscopie est une technique d'endoscopie permettant l'exploration visuelle de certains conduits et de certaines cavités du corps. Une fibroscopie est une technique d'endoscopie permettant l'exploration visuelle de certains conduits et de certaines cavités du corps. |
14/01/2008
- Le dépistage du cancer colorectal est étendu à tout le territoire Français.
 Engagé depuis 2002, le dépistage du cancer colorectal doit être généralisé à tous les départements Français cette année. Engagé depuis 2002, le dépistage du cancer colorectal doit être généralisé à tous les départements Français cette année. |
11/05/2007
- AFISCep : Mise en ligne des photos du congrès du 21 mars 2007
 La galerie photos du congrès des infirmières stomathérapeutes est consultable en ligne La galerie photos du congrès des infirmières stomathérapeutes est consultable en ligne |
10/05/2007
- Stomie : Que dois-je dire à mes amis et à ma famille à propos de la stomie de mon enfant ?
 Vous ne leur dites que ce que vous voulez dévoiler. Vous pouvez en parler à la famille immédiate seulement ... Vous ne leur dites que ce que vous voulez dévoiler. Vous pouvez en parler à la famille immédiate seulement ... |
09/05/2007
- Direction générale des personnes handicapées : Enquête relative aux besoins d'informations.
 Enquête relative aux besoins d'informations à l'intention des professionnels (travailleurs sociaux et collaborateurs de première ligne exclusivement) Enquête relative aux besoins d'informations à l'intention des professionnels (travailleurs sociaux et collaborateurs de première ligne exclusivement) |
08/05/2007
- Soins infirmiers : Arrêté Royal fixant une intervention sur la gestion informatique des dossiers.
 Arrêté Royal fixant l'intervention financière aux infirmiers utilisant la gestion informatique de leurs patients. Arrêté Royal fixant l'intervention financière aux infirmiers utilisant la gestion informatique de leurs patients. |
13/01/2008
- Congrès de stomathérapie organisé par l’AFISCeP le 11 mars 2008.
 Samedi dernier, nous vous avons annoncé que l’AFISCeP organisait son congrès annuel le 11 mars prochain. Lors de la présentation de ce congrès, j’ai... Samedi dernier, nous vous avons annoncé que l’AFISCeP organisait son congrès annuel le 11 mars prochain. Lors de la présentation de ce congrès, j’ai... |
07/05/2007
- Chine : 200 000 personnes décèdent chaque année de cancers.
 Chaque année, au moins 200 000 personnes décèdent de cancers liés à leurs lieux de travail, selon l'Organisation mondiale de la Santé (OMS) Chaque année, au moins 200 000 personnes décèdent de cancers liés à leurs lieux de travail, selon l'Organisation mondiale de la Santé (OMS) |
06/05/2007
- Canada : Le cancer de plus en plus mortel
 Une nouvelle étude prévoit que le cancer pourrait dépasser prochainement les maladies cardiovasculaires ... Une nouvelle étude prévoit que le cancer pourrait dépasser prochainement les maladies cardiovasculaires ... |
| |
|
|
|
 |
|
 |

